电子键是什么_空细劫同学化学作业《电子键是什么》归类分享_化学_空细劫
编辑: admin 2017-26-06
-
4
电子键是什么导读:
学好数理化走遍天下都不怕,这说明化学很重要,那么同学们就要多多练习化学作业,我们就一起来看看空细劫同学的这道化学题,将给我们带来了哪些化学解题方法呢?电子键是什么这道题主要考察的是化学基本知识,是空细劫精心归类总结的化学作业题——《电子键是什么:原子键到底是什么是电子吗》,指导老师是戴老师,涉及到的化学课本知识为:原子键到底是什么是电子吗,这道题的难度适中,考点为电子键是什么:原子键到底是什么是电子吗的相关化学知识点,用所学的相关化学知识来进行解答,下面是空细劫化学作业的详细归类分享(本道题以问答模式展开)。
题目:原子键到底是什么是电子吗
电子键是什么:逆火学习站的空细劫同学的作业题:《原子键到底是什么是电子吗》解题思路
知道分子键吧,那如果是原子组成的单质,里面没有分子,但是还是要有范德华力的,这就来源于原子键,准确的说也可以归为分子键一类,是特殊形式互助这道作业题的同学还参与了下面的作业题
题1: 原子键到底是什么我文化水平浅原子键一定要说的详细简单为什么原子会组成到一起?
知道分子键吧,那如果是原子组成的单质,里面没有分子,但是还是要有范德华力的,这就来源于原子键,准确的说也可以归为分子键一类,是特殊形式题2: 碳原子最外层有()个电子每个碳原子与其他原子形成()个共键价;碳原子可以通过C-C、()或()等共价键结合成碳链,也可以连接形成().[化学科目]
碳原子最外层有( 4 )个电子 每个碳原子与其他原子形成( 4 )个共键价;电子键是什么:逆火学习站的空细劫同学的作业题:《原子键到底是什么是电子吗》解题思路
碳原子可以通过C-C、(C=C )或(C≡C )等共价键结合成碳链,也可以连接形成( 环形 ).题3: 乙硼烷中三原子二电子键什么意思[化学科目]
乙硼烷中,硼原子是sp3杂化.因为硼外层三个电子,故只有三个sp3杂化轨道上有一个电子,这三个杂化轨道分别和H成σ键.另一个sp3杂化轨道是空轨道.电子键是什么:逆火学习站的空细劫同学的作业题:《原子键到底是什么是电子吗》解题思路
两个硼原子靠近生成乙硼烷时,第一个硼原子的空sp3杂化轨道与第二个硼原子上带的一个氢原子接近成键,这样生成一个B-H—B的香蕉状的键,这个键包含三个原子核(B、H、B),但只有两个电子(第一个B原子使用的是空轨道,第二个硼原子使用和H成键的轨道,B、H各一个电子,一共两个电子),因此称为三中心二电子键.电子键是什么:逆火学习站的空细劫同学的作业题:《原子键到底是什么是电子吗》解题思路
同样,第二个硼原子的空sp3杂化轨道与第一个硼原子上带的一个氢原子接近成键,也会生成一个香蕉状的三中心两电子键.乙硼烷中有两个这样的键.电子键是什么:逆火学习站的空细劫同学的作业题:《原子键到底是什么是电子吗》解题思路
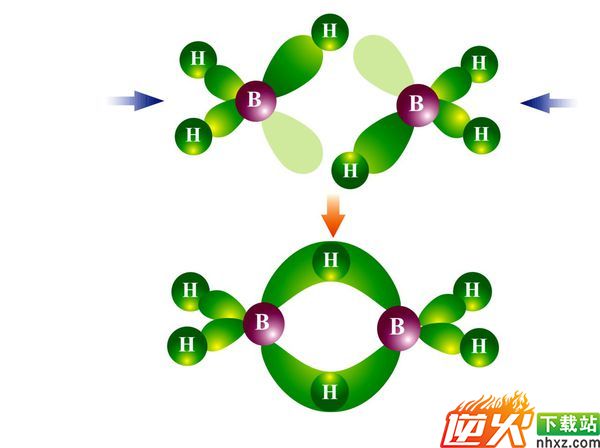
题4: 大π键中的电子算那个原子的?比如NO3-,应该不是均摊给那4个原子吧,因为没有大π键中的电子时,N最外层已经有8个电子了[化学科目]
确实应该均摊,因为电子是离域的题5: 如何确定电子式原子间成键对数如上,谢谢~[化学科目]
一,路易斯理论1,路易斯理论电子键是什么:逆火学习站的空细劫同学的作业题:《原子键到底是什么是电子吗》解题思路
1916年,美国的 Lewis 提出共价键理论.认为分子中的原子都有形成稀有气体电子结构的趋势(八隅律),求得本身的稳定.而达到这种结构,并非通过电子转移形成离子键来完成,而是通过共用电子对来实现.通过共用一对电子,每个H均成为 He 的电子构型,形成共价键.2,路易斯结构式分子中还存在未用于形成共价键的非键合电子,又称孤对电子.添加了孤对电子的结构式叫路易斯结构式.如:H:H 或 H—H :N≡N: O=C=O C2H2(H—C≡C—H)有些分子可以写出几个式子(都满足8电子结构),如HOCN,可以写出如下三个式子:哪一个更合理 可根据结构式中各原子的"形式电荷"进行判断:q = n v-n L-n b式中,q为 n v为价电子数 n L为孤对电子数 n b为成键电子数.判断原则: 越接近于零,越稳定.所以,稳定性Ⅰ>Ⅱ>Ⅲ电子键是什么:逆火学习站的空细劫同学的作业题:《原子键到底是什么是电子吗》解题思路
Lewis的贡献在于提出了一种不同于离子键的新的键型,解释了△X 比较小的元素之间原子的成键事实.但Lewis没有说明这种键的实质,适应性不强.在解释BCl3, PCl5 等未达到稀有气体结构的分子时,遇到困难.二,价键理论电子键是什么:逆火学习站的空细劫同学的作业题:《原子键到底是什么是电子吗》解题思路
1927年,Heitler 和 London 用量子力学处理氢气分子H2,解决了两个氢原子之间化学键的本质问题,并将对 H2 的处理结果推广到其它分子中,形成了以量子力学为基础的价键理论(V. B. 法)1,共价键的形成电子键是什么:逆火学习站的空细劫同学的作业题:《原子键到底是什么是电子吗》解题思路
A,B 两原子各有一个成单电子,当 A,B 相互接近时,两电子以自旋相反的方式结成电子对,即两个电子所在的原子轨道能相互重叠,则体系能量降低,形成化学键,亦即一对电子则形成一个共价键.形成的共价键越多,则体系能量越低,形成的分子越稳定.因此,各原子中的未成对电子尽可能多地形成共价键.例如:H2 中,可形成一个共价键;HCl 分子中,也形成一个共价键.N2 分子怎样呢 已知N 原子的电子结构为:2s22p3 每个N原子有三个单电子,所以形成 N2 分子时,N 与N 原子之间可形成三个共价键.写成:电子键是什么:逆火学习站的空细劫同学的作业题:《原子键到底是什么是电子吗》解题思路
形成CO分子时,与 N2 相仿,同样用了三对电子,形成三个共价键.不同之处是,其中一对电子在形成共价键时具有特殊性.即C 和 O各出一个 2p 轨道重叠,而其中的电子是由O单独提供的.这样的共价键称为共价配位键.于是,CO 可表示成: 配位键形成条件:一种原子中有孤对电子,而另一原子中有可与孤对电子所在轨道相互重叠的空轨道.在配位化合物中,经常见到配位键.2,共价键的特征——饱和性,方向性电子键是什么:逆火学习站的空细劫同学的作业题:《原子键到底是什么是电子吗》解题思路
饱和性:几个未成对电子(包括原有的和激发而生成的),最多形成几个共价键.例如:O有两个单电子,H有一个单电子,所以结合成水分子,只能形成2个共价键;C最多能与H 形成4个共价键.方向性:各原子轨道在空间分布是固定的,为了满足轨道的最大重叠,原子间成共价键时,当然要具有方向性. 如: HClCl的3p 和H的1s轨道重叠,要沿着z轴重叠,从而保证最大重叠,而且不改变原有的对称性.再如:Cl2 分子,也要保持对称性和最大重叠.3,共价键键型成键的两个原子间的连线称为键轴.按成键与键轴之间的关系,共价键的键型主要为两种:(1)键 键特点:将成键轨道,沿着键轴旋转任意角度,图形及符号均保持不变.即键轨道对键轴呈圆柱型对称,或键轴是n重轴.(2)键键特点:成键轨道围绕键轴旋转180°时,图形重合,但符号相反. 如:两个2 p 沿 z 轴方向重叠:YOZ 平面是成键轨道的节面,通过键轴.则键的对称性为:通过键轴的节面呈现反对称(图形相同,符号相反). 为"肩并肩"重叠.N2 分子中: 两个原子沿z轴成键时,p 与 p "头碰头"形成键,此时,p和p,p和p以"肩并肩"重叠,形成键.1个键,2个键.4,共价键的键参数(1)键能AB(g) = A(g) + B(g) △H = EAB = DAB 对于双原子分子,解离能DAB等于键能EAB,但对于多原子分子,则要注意解离能与键能的区别与联系,如NH3:NH3(g) = H(g) +NH2(g) D1 = 435.1 kJ·mol-1NH2(g) = H(g) +NH(g) D2 = 397.5 kJ·mol-1NH(g) = H(g) +N(g) D3 = 338.9 kJ·mol-1三个D值不同,而且:E=(D1+D2+D3)/ 3 =390.5 kJ·mol-1.另外,E可以表示键的强度,E越大,则键越强.(2)键长分子中成键两原子之间的距离,叫键长.一般键长越小,键越强.例如:表5-1 几种碳碳键的键长和键能键长/pm键能/ kJ·mol-1C—C154345.6C==C133602.0120835.1另外,相同的键,在不同化合物中,键长和键能不相等.例如:CH3OH中和C2H6 中均有C—H键,而它们的键长和键能不同.(3)键角电子键是什么:逆火学习站的空细劫同学的作业题:《原子键到底是什么是电子吗》解题思路
是分子中键与键之间的夹角(在多原子分子中才涉及键角).如:H2S 分子,H—S—H 的键角为 92°,决定了H2S 分子的构型为"V"字形;又如:CO2中,O—C—O的键角为180°,则CO2分子为直线形.因而,键角是决定分子几何构型的重要因素.(4)键的极性极性分子的电场力以偶极矩表示.偶极矩μ=g(静电单位)×d(距离,cm)即德拜(D)三,杂化轨道理论杂化:成键过程是由若干个能量相近的轨道经叠加,混合,重新调整电子云空间伸展方向,分配能量形成新的杂化轨道过程.1,理论要点:①成键原子中几个能量相近的轨道杂化成新的杂化轨道;②参加杂化的原子轨道数 = 杂化后的杂化轨道数.总能量不变;③杂化时轨道上的成对电子被激发到空轨道上成为单电子,需要的能量可以由成键时释放的能量补偿.2,杂化轨道的种类(1)按参加杂化的轨道分类s-p 型:sp 杂化,sp杂化和sp杂化s-p-d型:spd杂化, spd杂化(2)按杂化轨道能量是否一致分类等性杂化, 如C 的sp杂化:4 个sp杂化轨道能量一致. 形成3个能量相等的sp杂化轨道,属于等性杂化.判断是否是等性杂化,要看各条杂化轨道的能量是否相等,不看未参加杂化的轨道的能量. 3,各种杂化轨道在空间的几何分布杂化类型 sp3 sp2 sp sp3d或dsp3 sp3d2或d2sp3立体构型 正四面体 正三角形 直线形 三角双锥体 正八面体4,用杂化轨道理论解释构型(1)sp 杂化BeCl2分子,直线形,用杂化轨道理论分析其成键情况,说明直线形的原因. Be:1s22s22p0sp 杂化:2 条sp杂化轨道是直线形分布,分别与 2 个 Cl 的3p轨道成键,故分子为直线形.sp杂化,sp-1s,sp-sp均为键.C中未杂化的p与另一C中未杂化的p沿纸面方向形成π键;而p 与p沿与纸面垂直的方向形成π键.二氧化碳,直线形,C发生sp杂化,C 与 O 之间 sp-2px 两个键,所以,O—C—O 成直线形.电子键是什么:逆火学习站的空细劫同学的作业题:《原子键到底是什么是电子吗》解题思路
C中未杂化的py与两侧 O 的两个py沿纸面方向成大π键,C 中未杂化的pz与两侧 O 的pz沿垂直于纸面的方向成π键,故 CO2 中,C,O之间有离域π键(两个∏大π键).(2)sp2杂化BCl3 平面三角形构型,B的 3 个sp2杂化轨道呈三角形分布,分别与 3 个 Cl 的 3p 成σ键,分子构型为三角形.属于sp2杂化.电子键是什么:逆火学习站的空细劫同学的作业题:《原子键到底是什么是电子吗》解题思路
乙烯 C发生sp2杂化,sp2杂化轨道与sp2杂化轨道形成1个C–C σ键,sp2杂化轨道与H的1s轨道形成4个C–H σ键;未杂化的p轨道之间形成π键,故分子中有碳碳双键存在.(3)sp3杂化电子键是什么:逆火学习站的空细劫同学的作业题:《原子键到底是什么是电子吗》解题思路
甲烷 C发生sp3杂化,4个轨道呈正四面体分布,4个sp3杂化轨道分别与4个H的1s轨道形成σ键,因没有未杂化的电子(轨道),故CH4分子中无双键.(4) s-p-d 杂化PCl5 三角双锥,P:1s22s22p63s23p33d 0 5个sp3d 杂化轨道呈三角双锥形分布,分别与 5 个Cl 的 3p成σ键.空间图形为:(5)不等性杂化H2O O发生sp3不等性杂化:电子键是什么:逆火学习站的空细劫同学的作业题:《原子键到底是什么是电子吗》解题思路
两个含单电子的sp3杂化轨道与2个H的1s轨道形成σ键,含孤电子对的两个sp3杂化轨道不成键,故水呈V形结构.水分子中的O–H键的夹角本应为109°28',但由于孤电子对的斥力,键角变小,为104°45'.NH3 N发生sp3不等性杂化:电子键是什么:逆火学习站的空细劫同学的作业题:《原子键到底是什么是电子吗》解题思路
单电子占据的sp3杂化轨道分别与 H 的1s成σ键,孤对电子占据的sp3单独占据四面体的一个顶角.由于孤对电子的影响,H—N—H键的键角小于109°28′,为107°18′.电子键是什么:逆火学习站的空细劫同学的作业题:《原子键到底是什么是电子吗》解题思路
在等性杂化中由分子构型(与电子对构型一致)可以直接看出杂化方式.但在不等性杂化中,分子结构当然与杂化方式有关,但要知道孤电子对数,方可确定分子构型.关键是电子对构型可以直接标志杂化方式,故电子对构型非常重要.不等性杂化与配体数小于对数是对应的.有未参加杂化的电子,一般形成π键或大π键.四,价层电子对互斥理论(Valance Shell Electron Pair Repulsion Theory)简称VSEPR适用AD m 型分子1,理论要点:①AD m 型分子的空间构型总是采取A的价层电子对相互斥力最小的那种几何构型;②分子构型与价层电子对数有关(包括成键电子对和孤电子对);③分子中若有重键(双,叁键)均视为一个电子对;④电子对的斥力顺序:孤对电子对与孤对电子对间斥力>孤对与键对间>键对与键对间;键对电子对间斥力顺序叁键与叁键>叁数与双键>双键与双键>双键与单键>单与单键.2,判断共价分子构型的一般规则——经验总结第一步:计算中心原子的价层电子对数=(中心离子电子数+配对原子提供电子总数)注意:①氧族元素的氧做中心时:价电子数为 6, 如 H2O,H2S;做配体时:提供电子数为 0,如在 CO2中.②处理离子体系时,要加减离子价.如PO 5+(0×4)+3 = 8;NH 5+(1×4)-1 = 8.③结果为单电子时视作有一个电子对.例:IF5 价层电子对数为[7+(5×1)] = 6对 正八面体(初步判断)N H 价层电子对数为[5+(4×1)-1] = 4对 正四面体PO 价层电子对数为[5+(0×4)+3] = 4对 正四面体NO2 价层电子对数为[5+0] = 2.53对 平面三角形第二步:计算中心原子的孤对电子对数 Lp = (中心离子价层电子数—几个配位原子的未成对电子数) IF5 Lp=[7-(5×1)] = 1 构型由八面体四方锥NH Lp =[(5-1)-(4×1)] = 0 正四面体PO Lp =[(5+3)-(4×2)] = 0 正四面体SO Lp =[(6+2)-(4×2)] = 0 正四面体NO2 Lp =[5-(2×2)] = 1 构型由三角形V形SO Lp =[(6+2)-(3×2)] = 1 构型由四面体三角锥表5-2 价层电子对数与分子空间构型 杂化类型键对电子对数孤对电子对数分子类型分子空间构型实例2sp2OAB2直线形BeCl2,CO2,HgCl23sp23OAB3平面三角BF3,BCl3,SO3,CO32 ,NO3 21AB2V形SO2,SnCl2,NO2 4sp34OAB4正四面体CH4,CHCl3,CCl4,NH4+,SO42 ,PO43 31AB3三角锥NH3,NF3,SO32 22AB2V形H2O,SCl2,ClO2 5sp3d5OAB5双三角锥PCl5,AsF541AB4变形四面体TeCl4,SF432AB3T形ClF323AB2直线形XeF2,I3 6sp3d260AB6正八面体SF6,[SiF6]2 51AB5四方锥IF5,[SbF5]2 42AB4平面四方形XeF4价层电子对互斥理论局限性:①对于复杂的多元化合物无法处理;②无法说明键的形成原理和键的相对稳定性.五,离域π键(大π键)电子键是什么:逆火学习站的空细劫同学的作业题:《原子键到底是什么是电子吗》解题思路
1,定义:在多原子分子中如有相互平行的p轨道,它们连贯重叠在一起构成一个整体,p电子在多个原子间运动形成π型化学键,这种不局限在两个原子之间的π键称为离域π键,或大π键.以∏表示.n为参与大π键的原子数,m为大π键的电子数.电子键是什么:逆火学习站的空细劫同学的作业题:《原子键到底是什么是电子吗》解题思路
∏ 中m = n时,称正常离域π键,如苯分子中含∏;m>n时形成多电子离域π键,如苯胺分子中含∏;m109°28',而∠ClPCl109°28',而∠ClPCl109°28', 而∠ClPCl0,淡黄色者μ=0.试画出两种异构体的构型图,并比较在水中的溶解度.构型图:淡黄色 ,棕黄色 ;在水中溶解度较大的是 .9,填表:分子或离子NO2SO3NHTeCl4IF5中心原子杂化类型中心原子孤电子对数分子中σ键数分子中π键数分子形状10,已知NO,CO互为等电子体,为什么不包括SiO,PO 11,假设有一个分子只含有H,N,B其,中H∶N∶B=2∶1∶1,它的分子量为80.4,且发现它是非极性分子,抗磁性分子.(1)此分子有两种可能构型A和B,其中A比B要稳定.请画出它们的结构式,并说明为什么A比B要稳定 (2)说明A和B分子中化学键的类型;(3)说明A和B分子为什么是非极性抗磁性分子;(4)标明A分子中成键骨架原子的形式电荷,并简述理由.12,请就BF3的有关知识回答下列问题:(1)几何构型及其成键情况;(2)分子是否有极性 (3)如果把BF3与乙醚放在一起,BF3键长从130pm增加到141pm,试问所成新化合物的成键情况及其极性如何 参考答案:1.(1) (2) (3)2.NCl5不能稳定存在.因为N属于第二周期元素,其可以稳定存在的化合物的最大配位数是4.3.解题思路:根据价层电子对互斥理论,计算单电子个数,价层电子对数,孤对电子对数,进而判断分子的构型(注意:必须考虑离子的价态!)4,(1)H2O或醚 (2)O,O2 (3)BX3,BX(X为卤族元素) (4)N2,NH或季铵盐类电子键是什么:逆火学习站的空细劫同学的作业题:《原子键到底是什么是电子吗》解题思路
5,(1) (2)NF3分子的极性比NH3分子的极性小.在这两个分子中,都有一个sp3杂化轨道为N原子的一对孤对电子所占据.对NF3来说,N-F键的极性较大,而且偶极矩指向F原子,而N原子中由于孤对电子产生的偶极矩是指向孤对电子,方向正好与N-F键产生的偶极矩相反,抵消了N-F键产生的偶极矩,所以N-F分子的极性较小;对于NH3来说,N-H键产生的偶极矩指向N原子,与N原子中由孤对电子产生的偶极矩的方向相同,使N-H键的极性加强,所以NH3分子的极性大.电子键是什么:逆火学习站的空细劫同学的作业题:《原子键到底是什么是电子吗》解题思路
6,丁二烯是一个平面形分子,碳原子均采用sp2杂化,每个sp2杂化轨道中均有一个p电子,四个碳原子用sp2杂化以碰头方式形成9个σ键,每个碳原子还剩下一个p轨道形成∏键,结构为:7,ArCl+,OF+,NO+,PS+,SCl+分子离子的杂化及成键形式,键级,成键轨道的周期数的关系列于下表中:杂化态键的性质键级成键轨道的周期数ArCl+sp3σ14~3OF+sp21σ+1∏22~2NO+sp1σ+2∏32~2PS+sp1σ+2∏33~3SCl+sp21σ+1∏23~3由键级可知,NO+,PS+稳定,AlCl+不稳定.由于NO+成键轨道为2p和2s,形成的键比PS+用3p和3s成键更稳定,所以NO+最稳定.电子键是什么:逆火学习站的空细劫同学的作业题:《原子键到底是什么是电子吗》解题思路
提示:本题主要考查键级对分子或离于稳定性的影响.一般来说,键级越大,分子越稳定.相同键级的分子则看成键轨道的能级大小,能级越低,成键越稳定.8,(1)CS2 (2)邻>间>对 (3)三角锥形 (4)平面三角形 (5) ; ;棕黄色者9,分子或离子NO2SO3NHTeCl4IF5中心原子杂化类型sp2sp2sp3sp3dsp3d2中心原子孤电子对数1/20011分子中σ键数23445分子中π键数1个∏1个∏000分子形状V平面形四面体四方锥伞形电子键是什么:逆火学习站的空细劫同学的作业题:《原子键到底是什么是电子吗》解题思路
10,NO与PO的结构不同在于PO中的P原子有d轨道成键,SiO是化学式,它是SiO以2个氧分别和另外2个SiO2相联成长链或环状物质的化学式,不像CO那样是一个单独存在的离子单元.11,(1)A:; B:电子键是什么:逆火学习站的空细劫同学的作业题:《原子键到底是什么是电子吗》解题思路
从立体几何的角度看,A式为六元环结构,比B式三元环结构稳定,三元环的张力太大;从纯化学的角度看:A式中的N,B均以sp2杂化轨道成键;在A中,3个N原子的pz轨道上3对孤对电子与3个B原子的空pz轨道形成6中心,6电子的离域π键,而B式却不能形成离域π键.所以A式比B式稳定.(2)A:B,N sp2杂化,一个∏;B:B,N sp3杂化 (3)在成键情况下,上面的两个式子中B,N都没有成单电子,所以都是抗磁性分子.(4)电子键是什么:逆火学习站的空细劫同学的作业题:《原子键到底是什么是电子吗》解题思路
由于A式中的离域π键的形成是N原子将孤对电子提供给B原子(B原子是缺电子原子),综合考虑,N原子因而少电子,因此N原子显示正电荷,B原子显示负电荷.12,(1)B为sp2杂化,平面分子,有大π键∏;(2)非极性,因结构对称;(3)B由sp2杂化变为sp3杂化.因B缺电子,有空轨道,能接受乙醚分子中O的孤对电子,形成新的化学键.- - OOO:N N:O:C O:ClCl电子键是什么:逆火学习站(img1.72589.com)的空细劫同学的作业题:《原子键到底是什么是电子吗》解题思路
电子键是什么小结:
通过以上关于空细劫同学对电子键是什么:原子键到底是什么是电子吗的解题归类详细分享,相信同学们已经对电子键是什么的相关化学作业考点一定有所收获吧。建议同学们要学会归类总结,并仔细思考空细劫同学分享的解答《原子键到底是什么是电子吗》这道作业题的解题思路,把化学考试中可能涵盖的考点都在平时得到加强训练,才能让自己的化学考试获得好成绩。
