【气体制备】高中15种常见气体的制备原理_化学_情义光头Mmm
编辑: admin 2017-15-06
-
4
哈,我当年高考的时候整理过,已经多年了,来造福下后辈
1.常见气体的制取和检验(转)
⑴氧气
制取原理——含氧化合物自身分解
制取方程式——2KClO3 2KCl+3O2↑
装置——略微向下倾斜的大试管,加热
检验——带火星木条,复燃
收集——排水法或向上排气法
⑵氢气
制取原理——活泼金属与弱氧化性酸的置换
制取方程式——Zn+H2SO4 === H2SO4+H2↑
装置——启普发生器
检验——点燃,淡蓝色火焰,在容器壁上有水珠
收集——排水法或向下排气法
⑶氯气
制取原理——强氧化剂氧化含氧化合物
制取方程式——MnO2+4HCl(浓)MnCl2+Cl2↑+2H2O
装置——分液漏斗,圆底烧瓶,加热
检验——能使湿润的蓝色石蕊试纸先变红后褪色;
除杂质——先通入饱和食盐水(除HCl),再通入浓H2SO4(除水蒸气)
收集——排饱和食盐水法或向上排气法
尾气回收——Cl2+2NaOH=== NaCl+NaClO+H2O
⑷硫化氢
①制取原理——强酸与强碱的复分解反应
②制取方程式——FeS+2HCl=== FeCl2+H2S↑
③装置——启普发生器
④检验——能使湿润的醋酸铅试纸变黑
⑤除杂质——先通入饱和NaHS溶液(除HCl),再通入固体CaCl2(或P2O5)(除水蒸气)
⑥收集——向上排气法
⑦尾气回收——H2S+2NaOH=== Na2S+H2O或H2S+NaOH=== NaHS+H2O
⑸二氧化硫
①制取原理——稳定性强酸与不稳定性弱酸盐的复分解
②制取方程式——Na2SO3+H2SO4=== Na2SO4+SO2↑+H2O
③装置——分液漏斗,圆底烧瓶
④检验——先通入品红试液,褪色,后加热又恢复原红色;
⑤除杂质——通入浓H2SO4(除水蒸气)
⑥收集——向上排气法
⑦尾气回收——SO2+2NaOH=== Na2SO3+H2O
⑹二氧化碳
①制取原理——稳定性强酸与不稳定性弱酸盐的复分解
②制取方程式——CaCO3+2HClCaCl2+CO2↑+H2O
③装置——启普发生器
④检验——通入澄清石灰水,变浑浊
⑤除杂质——通入饱和NaHCO3溶液(除HCl),再通入浓H2SO4(除水蒸气)
⑥收集——排水法或向上排气法
⑺氨气
①制取原理——固体铵盐与固体强碱的复分解
②制取方程式——Ca(OH)2+2NH4ClCaCl2+NH3↑+2H2O
③装置——略微向下倾斜的大试管,加热
④检验——湿润的红色石蕊试纸,变蓝
⑤除杂质——通入碱石灰(除水蒸气)
收集——向下排气法
⑻氯化氢
①制取原理——高沸点酸与金属氯化物的复分解
②制取方程式——NaCl+H2SO4Na2SO4+2HCl↑
③装置——分液漏斗,圆底烧瓶,加热
④检验——通入AgNO3溶液,产生白色沉淀,再加稀HNO3沉淀不溶
⑤除杂质——通入浓硫酸(除水蒸气)
⑥收集——向上排气法
⑼二氧化氮
①制取原理——不活泼金属与浓硝酸的氧化—还原;
②制取方程式——Cu+4HNO3===Cu(NO3)2+2NO2↑+2H2O
③装置——分液漏斗,圆底烧瓶(或用大试管,锥形瓶)
④检验——红棕色气体,通入AgNO3溶液颜色变浅,但无沉淀生成
⑤收集——向上排气法
⑥尾气处理——3NO2+H2O===2HNO3+NO
NO+NO2+2NaOH===2NaNO2+H2O
⑩一氧化氮
①制取原理——不活泼金属与稀硝酸的氧化—还原;
②制取方程式——Cu+8HNO3(稀)===3Cu(NO3)2+2NO↑+4H2O
③装置——分液漏斗,圆底烧瓶(或用大试管,锥形瓶)
④检验——无色气体,暴露于空气中立即变红棕色
⑤收集——排水法
⑾一氧化碳
①制取原理——浓硫酸对有机物的脱水作用
②制取方程式——HCOOHCO↑+H2O
③装置——分液漏斗,圆底烧瓶
④检验——燃烧,蓝色火焰,无水珠,产生气体能使澄清石灰水变浑浊
⑤除杂质——通入浓硫酸(除水蒸气)
⑥收集——排水法
⑿甲烷
①制取方程式——CH3COONa+NaOH CH4↑+Na2CO3
②装置——略微向下倾斜的大试管,加热
③收集——排水法或向下排空气法
⒀乙烯
①制取原理——浓硫酸对有机物的脱水作用
②制取方程式——CH3CH2OH CH2=CH2↑+H2O
③装置——分液漏斗,圆底烧瓶,加热
④除杂质——通入NaOH溶液(除SO2,CO2),通入浓硫酸(除水蒸气)
收集——排水法
⒁乙炔
①制取原理——电石强烈吸水作用
②制取方程式——CaC2+2H2OCa(OH)2+CH CH↑
③装置——分液漏斗,圆底烧瓶(或用大试管,锥形瓶)
④检验——无色气体,能燃烧,产生明亮的火焰,并冒出浓的黑烟
⑤除杂质——通入硫酸铜溶液(除H2S,PH3),通入浓硫酸(除水蒸气)
收集——排水法或向下排气法
2.一些快速制法(即无需加热)(手打版)
1.O2 2H2O2=催化剂MnO2==2H2O+O2
2Na2O2 + 2H2O = 4Na+ + 4OH- +O2
2.Cl2 KMnO4与浓盐酸
16HCl+2KMnO4=2KCl+2MnCl2+8H2O+5Cl2
3.HCl 将浓硫酸逐滴加入浓HCl中
4.NH3 将CaO或者Ca(OH)2或者NaOH(皆为固体)加入浓氨水 加氧化钙是利用其与水反应消耗水且放热 加Ca(OH)2或者NaOH利用其与水反应放热
5.H2 NaH+H20→NaOH+H2↑(较少考,但03年上海考过)
互助这道作业题的同学还参与了下面的作业题
题1: 【高中化学实验制备气体原理总结尽快尽快...十万火急!拜托要答就别答没用的!=_=#感谢万分!】[化学科目]
1.常见气体的制取和检验(转)
⑴氧气
制取原理——含氧化合物自身分解
制取方程式——2KClO3 2KCl+3O2↑
装置——略微向下倾斜的大试管,加热
检验——带火星木条,复燃
收集——排水法或向上排气法
⑵氢气
制取原理——活泼金属与弱氧化性酸的置换
制取方程式——Zn+H2SO4 === H2SO4+H2↑
装置——启普发生器
检验——点燃,淡蓝色火焰,在容器壁上有水珠
收集——排水法或向下排气法
⑶氯气
制取原理——强氧化剂氧化含氧化合物
制取方程式——MnO2+4HCl(浓)MnCl2+Cl2↑+2H2O
装置——分液漏斗,圆底烧瓶,加热
检验——能使湿润的蓝色石蕊试纸先变红后褪色;
除杂质——先通入饱和食盐水(除HCl),再通入浓H2SO4(除水蒸气)
收集——排饱和食盐水法或向上排气法
尾气回收——Cl2+2NaOH=== NaCl+NaClO+H2O
⑷硫化氢
①制取原理——强酸与强碱的复分解反应
②制取方程式——FeS+2HCl=== FeCl2+H2S↑
③装置——启普发生器
④检验——能使湿润的醋酸铅试纸变黑
⑤除杂质——先通入饱和NaHS溶液(除HCl),再通入固体CaCl2(或P2O5)(除水蒸气)
⑥收集——向上排气法
⑦尾气回收——H2S+2NaOH=== Na2S+H2O或H2S+NaOH=== NaHS+H2O
⑸二氧化硫
①制取原理——稳定性强酸与不稳定性弱酸盐的复分解
②制取方程式——Na2SO3+H2SO4=== Na2SO4+SO2↑+H2O
③装置——分液漏斗,圆底烧瓶
④检验——先通入品红试液,褪色,后加热又恢复原红色;
⑤除杂质——通入浓H2SO4(除水蒸气)
⑥收集——向上排气法
⑦尾气回收——SO2+2NaOH=== Na2SO3+H2O
⑹二氧化碳
①制取原理——稳定性强酸与不稳定性弱酸盐的复分解
②制取方程式——CaCO3+2HClCaCl2+CO2↑+H2O
③装置——启普发生器
④检验——通入澄清石灰水,变浑浊
⑤除杂质——通入饱和NaHCO3溶液(除HCl),再通入浓H2SO4(除水蒸气)
⑥收集——排水法或向上排气法
⑺氨气
①制取原理——固体铵盐与固体强碱的复分解
②制取方程式——Ca(OH)2+2NH4ClCaCl2+NH3↑+2H2O
③装置——略微向下倾斜的大试管,加热
④检验——湿润的红色石蕊试纸,变蓝
⑤除杂质——通入碱石灰(除水蒸气)
收集——向下排气法
⑻氯化氢
①制取原理——高沸点酸与金属氯化物的复分解
②制取方程式——NaCl+H2SO4Na2SO4+2HCl↑
③装置——分液漏斗,圆底烧瓶,加热
④检验——通入AgNO3溶液,产生白色沉淀,再加稀HNO3沉淀不溶
⑤除杂质——通入浓硫酸(除水蒸气)
⑥收集——向上排气法
⑼二氧化氮
①制取原理——不活泼金属与浓硝酸的氧化—还原;
②制取方程式——Cu+4HNO3===Cu(NO3)2+2NO2↑+2H2O
③装置——分液漏斗,圆底烧瓶(或用大试管,锥形瓶)
④检验——红棕色气体,通入AgNO3溶液颜色变浅,但无沉淀生成
⑤收集——向上排气法
⑥尾气处理——3NO2+H2O===2HNO3+NO
NO+NO2+2NaOH===2NaNO2+H2O
⑩一氧化氮
①制取原理——不活泼金属与稀硝酸的氧化—还原;
②制取方程式——Cu+8HNO3(稀)===3Cu(NO3)2+2NO↑+4H2O
③装置——分液漏斗,圆底烧瓶(或用大试管,锥形瓶)
④检验——无色气体,暴露于空气中立即变红棕色
⑤收集——排水法
⑾一氧化碳
①制取原理——浓硫酸对有机物的脱水作用
②制取方程式——HCOOHCO↑+H2O
③装置——分液漏斗,圆底烧瓶
④检验——燃烧,蓝色火焰,无水珠,产生气体能使澄清石灰水变浑浊
⑤除杂质——通入浓硫酸(除水蒸气)
⑥收集——排水法
⑿甲烷
①制取方程式——CH3COONa+NaOH CH4↑+Na2CO3
②装置——略微向下倾斜的大试管,加热
③收集——排水法或向下排空气法
⒀乙烯
①制取原理——浓硫酸对有机物的脱水作用
②制取方程式——CH3CH2OH CH2=CH2↑+H2O
③装置——分液漏斗,圆底烧瓶,加热
④除杂质——通入NaOH溶液(除SO2,CO2),通入浓硫酸(除水蒸气)
收集——排水法
⒁乙炔
①制取原理——电石强烈吸水作用
②制取方程式——CaC2+2H2OCa(OH)2+CH CH↑
③装置——分液漏斗,圆底烧瓶(或用大试管,锥形瓶)
④检验——无色气体,能燃烧,产生明亮的火焰,并冒出浓的黑烟
⑤除杂质——通入硫酸铜溶液(除H2S,PH3),通入浓硫酸(除水蒸气)
收集——排水法或向下排气法
2.一些快速制法(即无需加热)(手打版)
1.O2 2H2O2=催化剂MnO2==2H2O+O2
2Na2O2 + 2H2O = 4Na+ + 4OH- +O2
2.Cl2 KMnO4与浓盐酸
16HCl+2KMnO4=2KCl+2MnCl2+8H2O+5Cl2
3.HCl 将浓硫酸逐滴加入浓HCl中
4.NH3 将CaO或者Ca(OH)2或者NaOH(皆为固体)加入浓氨水 加氧化钙是利用其与水反应消耗水且放热 加Ca(OH)2或者NaOH利用其与水反应放热
5.H2 NaH+H20→NaOH+H2↑(较少考,但03年上海考过)
题2: 【实验室常见气体制备】[生物科目]
制取O2:2KClO3==MnO2,△==2KCl+3O2↑
制取CO2:2HCl+CaCO3==CaCl2+H2O+CO2↑
制取H2:Zn+H2SO4==ZnSO4+H2↑
制取H2S:H2SO4+FeS==H2S↑+FeSO4
制取SO2:H2SO4+Na2SO3==Na2SO4+H2O+SO2↑
题3: 【用最常用的反应原理制备下列气体的发生装置相同的是()?A.氧气和氨气B.氯气和氢气C.二氧化碳和氯气D.氯化氢和氧气为什么?不能选D?】[化学科目]
A
A、均为固固加热制气
B、制氯气加热
C、同上
D、制氯化氢是液体间的反应,制氧为固固加热制气
题4: 高中常见气体的化学实验室制法[化学科目]
气体名称:氧气
化学式:O2
相对分子质量:32
反应方程式:2KClO3=(MnO2)=△=2KCl+3O2↑
基本反应类型:分解反应
反应物状态:固固加热
水溶性:难溶
颜色:无色
气味:无味
收集方法:向上排空气法,排水法
排空气验满方法:带火星木条,复燃
可选用的干燥剂:浓H2SO4,无水CuSO4,碱石灰,无水CaCl2,P2O5
其他制取方法:2KMnO4=△=K2MnO4+MnO2+O2↑;2H2O2=(MnO2)=2H2O+O2↑
注意事项:KClO3催化分解时试管中不能混有任何可燃物,否则引起爆炸.
气体名称:氢气
化学式:H2
相对分子质量:2
反应方程式:Zn+H2SO4(稀)=ZnSO4+H2↑
基本反应类型:置换反应
反应物状态:固液常温
水溶性:难溶
颜色:无色
气味:无味
收集方法:向下排空气法,排水法
可选用的干燥剂:浓H2SO4,无水CuSO4,碱石灰,无水CaCl2,P2O5
其他制取方法:2Al+2NaOH+2H2O=2NaAlO2+3H2↑;CaH2+2H2O=Ca(OH)2+2H2↑
注意事项:不能使用浓H2SO4和任何浓度的HNO3.点燃或加热前必须验纯,以免爆炸.
气体名称:氯气
化学式:Cl2
相对分子质量:71
反应方程式:MnO2+4HCl(浓)=△=MnCl2+Cl2↑+2H2O
反应物状态:固液加热
水溶性:可溶(1:2)
颜色:黄绿色
气味:刺激性气味(有毒!)
收集方法:向上排空气法,排饱和食盐水法
排空气验满方法:观察颜色;湿润的淀粉-KI试纸,试纸变蓝
可选用的干燥剂:浓H2SO4,无水CuSO4,无水CaCl2,P2O5
其他制取方法:KClO3+6HCl=KCl+3Cl2↑+3H2O;2KMnO4+16HCl=2MnCl2+2KCl+5Cl2+8H2O
注意事项:必须在通风橱中操作,尾气用碱吸收,以免污染大气.
气体名称:氮气
化学式:N2
相对分子质量:28
反应方程式:NaNO2(固体)+NH4Cl(饱和)=△=NaCl+N2↑+2H2O
反应物状态:固液加热
水溶性:难溶
颜色:无色
气味:无味
收集方法:排水法,向下排空气法
排空气验满方法:燃着的木条,熄灭
可选用的干燥剂:浓H2SO4,无水CuSO4,碱石灰,无水CaCl2,P2O5
其他制取方法:(NH4Cr2O7)=△=N2↑+Cr2O3+4H2O;NH3+3CuO=△=N2↑+3Cu+3H2O;2NaN3=△=2Na+3N2↑
气体名称:氯化氢
化学式:HCl
相对分子质量:36.5
反应方程式:NaCl+H2SO4(浓)=△=NaHSO4+HCl↑
基本反应类型:复分解反应
反应物状态:固液加热
水溶性:极易溶(1:500)
颜色:无色
气味:刺激性气味
收集方法:向上排空气法
排空气验满方法:蘸有浓氨水的玻璃棒,出现白雾
可选用的干燥剂:浓H2SO4,无水CuSO4,无水CaCl2,P2O5
其他制取方法:MgCl2?6H2O=△=2HCl↑+MgO+5H2O
气体名称:氟化氢
化学式:HF
相对分子质量:20
反应方程式:CaF2+H2SO4(浓)=△=CaSO4+2HF↑
基本反应类型:复分解反应
反应物状态:固液加热
水溶性:极易溶
颜色:无色
气味:刺激性气味(有毒!)
收集方法:向下排空气法
排空气验满方法:蘸有浓氨水的玻璃棒,出现白雾
可选用的干燥剂:浓H2SO4,无水CuSO4,P2O5
注意事项:不能使用玻璃仪器.必须在通风橱中操作,尾气用碱吸收,以免污染大气.
气体名称:溴化氢
化学式:HBr
相对分子质量:81
反应方程式:NaBr+H3PO4(浓)=△=NaH2PO4+HBr↑
基本反应类型:复分解反应
反应物状态:固液加热
水溶性:极易溶
颜色:无色
气味:刺激性气味(有毒!)
收集方法:向上排空气法
排空气验满方法:蘸有浓氨水的玻璃棒,出现白雾
可选用的干燥剂:无水CuSO4,无水CaCl2,P2O5
其他制取方法:2P+3Br2+6H2O=2H3PO3+6HBr↑
注意事项:不能用浓H2SO4代替H3PO4,这样制出的HBr会被氧化.必须在通风橱中操作,尾气用碱吸收,以免污染大气.可将NaBr换成NaI制取HI.
气体名称:硫化氢
化学式:H2S
相对分子质量:34
反应方程式:FeS+H2SO4(稀)=FeSO4+H2S↑
基本反应类型:复分解反应
反应物状态:固液常温
水溶性:易溶(1:2.6)
颜色:无色
气味:类似臭鸡蛋的刺激性气味(有毒!)
收集方法:向上排空气法
排空气验满方法:湿润的Pb(Ac)2试纸,试纸变黑
可选用的干燥剂:无水CaCl2,P2O5
其他制取方法:Al2S3+6H2O=2Al(OH)3+3H2S↑
注意事项:不能使用浓H2SO4和任何浓度的HNO3.必须在通风橱中操作,尾气用碱吸收,以免污染大气.
气体名称:氨气
化学式:NH3
相对分子质量:17
反应方程式:Ca(OH)2+2NH4Cl=△=CaCl2+2NH3↑+2H2O
反应物状态:固固加热
水溶性:极易溶(1:700)
颜色:无色
气味:刺激性气味
收集方法:向下排空气法
排空气验满方法:蘸有浓盐酸的玻璃棒,出现白雾
可选用的干燥剂:碱石灰
其他制取方法:Mg3N2+6H2O=3Mg(OH)2+2NH3↑
气体名称:一氧化碳
化学式:CO
相对分子质量:28
反应方程式:HCOOH=(浓H2SO4)=△=H2O+CO↑
基本反应类型:分解反应
反应物状态:固液加热
水溶性:难溶
颜色:无色
气味:无味(有毒!)
收集方法:排水法,向下排空气法
可选用的干燥剂:浓H2SO4,无水CuSO4,碱石灰,无水CaCl2,P2O5
其他制取方法:C+CO2=高温=2CO;H2C2O4=(浓H2SO4)=△=H2O+CO↑+CO2↑
注意事项:必须在通风橱中操作.点燃或加热前必须验纯,以免爆炸.尾气可点燃除去,以免污染大气.
气体名称:二氧化碳
化学式:CO2
相对分子质量:44
反应方程式:CaCO3+2HCl=CaCl2+CO2↑+H2O
反应物状态:固液常温
水溶性:能溶(1:1)
颜色:无色
气味:无味
收集方法:向上排空气法
排空气验满方法:燃着的木条,熄灭
可选用的干燥剂:浓H2SO4,无水CuSO4,无水CaCl2,P2O5
注意事项:不能用H2SO4代替HCl,因生成CaSO4沉淀阻碍反应继续进行.
气体名称:二氧化硫
化学式:SO2
相对分子质量:64
反应方程式:Na2SO3(固)+H2SO4(中等浓度)=Na2SO4+SO2↑+H2O
反应物状态:固液常温
水溶性:易溶(1:40)
颜色:无色
气味:刺激性气味(有毒!)
收集方法:向上排空气法
排空气验满方法:湿润的品红试纸,试纸腿色
可选用的干燥剂:浓H2SO4,无水CuSO4,无水CaCl2,P2O5
其他制取方法:2H2SO4(浓)+S=△=3SO2↑+2H2O
注意事项:必须在通风橱中操作,尾气用碱吸收,以免污染大气.
气体名称:一氧化二氮
化学式:N2O
相对分子质量:44
反应方程式:NH4NO3=190℃~300℃=N2O↑+2H2O
基本反应类型:分解反应
反应物状态:固体控制温度加热
水溶性:能溶
颜色:无色
气味:略带甜味(微毒,吸入少量后能使人面部肌肉痉挛,可使人发笑,使人麻醉).
收集方法:向上排空气法
排空气验满方法:带火星木条,复燃
可选用的干燥剂:浓H2SO4,无水CuSO4,碱石灰,无水CaCl2,P2O5
其他制取方法:4Zn+10HNO3(约2mol/L)=4Zn(NO3)2+N2O↑+5H2O
气体名称:一氧化氮
化学式:NO
相对分子质量:28
反应方程式:3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O
反应物状态:固液常温(可加热以加快反应速率)
水溶性:难溶
颜色:无色
气味:刺激性气味(有毒!)
收集方法:排水法
可选用的干燥剂:浓H2SO4,无水CuSO4,碱石灰,无水CaCl2,P2O5
其他制取方法:3NO2+H2O=2HNO3+NO
注意事项:不能用排空气法收集.必须在通风橱中操作,尾气通入O2后用碱吸收,以免污染大气.
气体名称:二氧化氮
化学式:NO2
相对分子质量:46
反应方程式:Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O
反应物状态:固液常温
水溶性:和水反应
颜色:红棕色
气味:刺激性气味(有毒!)
收集方法:向上排空气法
排空气验满方法:观察颜色;湿润的淀粉-KI试纸,试纸变蓝
可选用的干燥剂:无水CuSO4,碱石灰,无水CaCl2,P2O5
注意事项:必须在通风橱中操作,尾气用碱吸收,以免污染大气.
气体名称:甲烷
化学式:CH4
相对分子质量:16
反应方程式:CH3COONa(无水)+NaOH=(CaO)=△=Na2CO3+CH4↑
反应物状态:固固加热
水溶性:难溶
颜色:无色
气味:无味
收集方法:排水法,向下排空气法
可选用的干燥剂:浓H2SO4,无水CuSO4,碱石灰,无水CaCl2,P2O5
其他制取方法:CH3COOH=400℃~600℃=(Cu)=CO2+CH4
注意事项:反应物必须足够干燥.点燃或加热前必须验纯,以免爆炸.
气体名称:乙烯
化学式:C2H4
相对分子质量:28
反应方程式:C2H5OH(无水)+(浓H2SO4)=170℃=C2H4↑+H2O
基本反应类型:分解反应
反应物状态:固液控制温度加热
水溶性:难溶
颜色:无色
气味:略带甜味
收集方法:排水法,向下排空气法
可选用的干燥剂:无水CuSO4,碱石灰,无水CaCl2,P2O5
注意事项:要使反应物迅速达到170℃,以免在140℃时生成乙醚.
气体名称:乙炔
化学式:C2H2
相对分子质量:26
反应方程式:CaC2+2H2O=Ca(OH)2+C2H2↑
基本反应类型:复分解反应
反应物状态:固液常温
水溶性:难溶
颜色:无色
气味:无味
收集方法:排水法,向下排空气法
可选用的干燥剂:无水CuSO4,碱石灰,无水CaCl2,P2O5
注意事项:水一定要一滴一滴地滴进,不能使用启普发生器,用饱和食盐水代替蒸馏水更好.
题5: 高中化学常见气体制备的方法,方程式,及仪器[化学科目]
常见气体制备
1.实验室制取气体的一般原则
(1)安全:避免和防止爆炸、燃烧、有毒物质外泄.
(2)方便:应用常用试剂、装置简单、操作方便.
(3)快速:反应时间不宜过长,过于剧烈的反应不安全,以反应速率适中为宜.
(4)生成物纯净(或虽含杂质但较易提纯),减少分离操作.
2.实验室制取气体的反应
(1)制取单质:用氧化还原反应.
(2)制取化合物:通常用复分解反应,如HCl、SO2、CO2、NH3、HNO3等;有时也可用氧化还原反应,如制NO2、NO等.
3.实验装置的安装、选择及操作步骤
(1)实验装置的安装顺序可用如下图表示:
(2)制取气体时各部分装置的选择依据:
①发生装置:所用试剂的状态及反应条件;
②收集装置:气体的水溶性及相对空气的密度大小、是否与空气中成分反应;
③净化装置:依据气体与杂质的性质的不同,使杂质被吸收或转化成所需物质;
④尾气处理(吸收)装置:根据所制气体是否有毒或污染环境来确定是否要安装尾气处理装置.有毒物质可用溶液吸收或燃烧去除.
(3)“气密性检查”在整个实验中的位置一般放在第二位,一般在装置连接好后、但在反应开始前检验气密性,决不可在药品混合并开始反应后检查气密性.
4.实验室制取气体的典型装置
主要掌握实验室三种不同类型制备气体的装置,以及三种不同类型的气体收集方法.根据气体的性质选择合适的干燥、净化和吸收装置.
实验室常用的三种不同类型制备气体的装置:
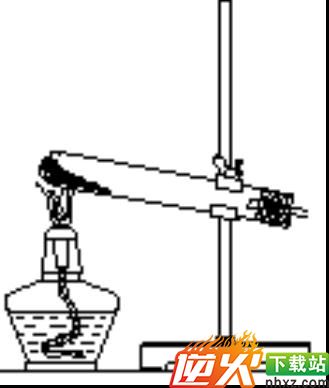
(1)固体——固体加热装置(见图)
所需仪器:铁架台、铁夹、酒精灯、大试管、单孔橡胶塞、导气管等.常用于制O2、NH3、CH4等.
注意事项:
①试管口应稍向下倾斜,以防止产生的水蒸气在管口冷凝后倒流而引起试管破裂.
②铁夹应夹在距试管口1/3处.
③固体药品要在试管底部平铺开.加热时首先均匀预热(移动酒精灯),然后在试管的药品最后部位集中加热,并逐步前移.
④胶塞上的导管伸入试管里面不能过长,否则会妨碍气体的导出.
⑤如用排水集气法收集气体,当停止制取气体时,应先从水槽中把导管撤出,然后再撤走酒精灯,以防水倒流.
(2)固体——液体(液体——液体)加热装置(见图)
所需仪器:铁架台、铁夹、烧瓶、分液漏斗、双孔塞、导管等.常用于制H2、CO2、H2S、NO2、SO2、NO等.
注意事项:
①烧瓶应固定在铁架台上.
②先把固体药品放入烧瓶中,然后再慢慢加入液体.
③分液漏斗内为挥发性液体时要盖上盖,注意盖上的小槽要对准分液漏斗颈上的小孔.
④制H2、CO2、H2S时也可用下面的装置.
这类装置使用方便,可以随时使反应发生或停止.
说明: ①在简易装置中长颈漏斗颈的下口应伸入液面以下,否则起不到液封作用而无法使用. ②加入的固体药品块状大小要适宜,如果太碎会落入底部的酸中使反应无法终止. ③加入酸的量要适当. ④最初使用时应待容器内原有的空气排净后,再收集气体. ⑤在导管口点燃氢气或其他可燃性气体时,必须先检验纯度.
5.气体发生装置气密性的检查
检验气密性时,可把导管一端浸入水里,用手掌紧贴烧瓶外壁,如果装置不漏气,烧瓶里的空气受热膨胀,导管口就会有气泡冒出.把手移开后,过一会儿烧瓶冷却,水就会上升到导管里,形成一段水柱(见下图I、Ⅱ).如果发现漏气,必须找出原因,并进行调整、修理或更换零件.