【在某过氧化氢溶液中】在某H2O2溶液中氢元素与氧元素的质量比为2:17,现向19..._化学_我不爱哥哥47
编辑: admin 2017-15-06
-
4
某H2O2溶液中H、O的质量比为2:17;
则:19g双氧水溶液中氢元素质量为:19g×22+17
根据过氧化氢分解的化学方程式可以知道,过氧化氢完全反应后生成水和氧气,该过程中氢元素的质量没有改变;所以反应后水的质量为:2g÷1×21×2+16×100%=18g
所以根据质量守恒定律可以知道生成氧气的质量为 19g-18g=1g;
故选A.
互助这道作业题的同学还参与了下面的作业题
题1: 【在某过氧化氢溶液中氢元素与氧元素的质量比为2:17,现在向19g该过氧化氢溶液中加入1g二氧化锰,充分反应后,生成氧气的质量为?】[化学科目]
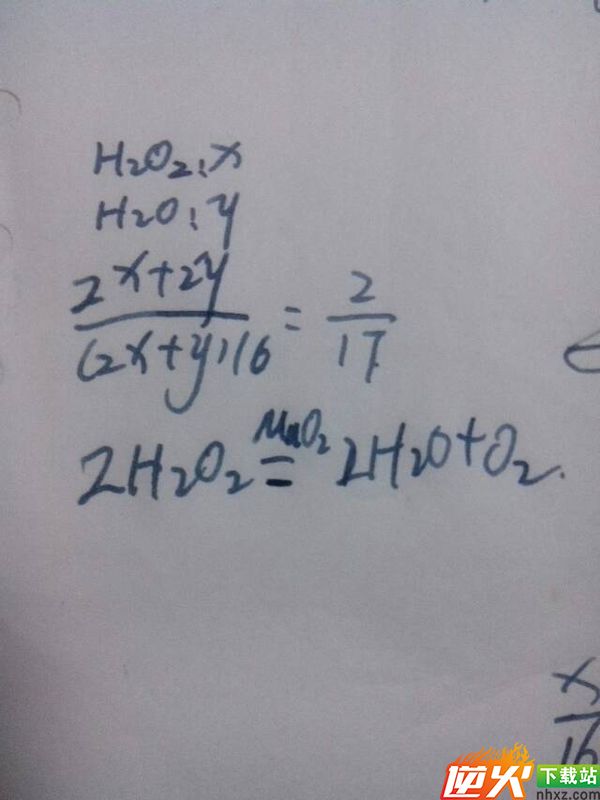
题2: 在某H2O2溶液中氢元素与氧元素的质量比为2:17,现向19g该H2O2溶液中加入1g二氧化锰,充分反应后,生成氧气的质量为?答案是1g,我看的解析式氢元素质量为2/17+2=2/19,19g=2g,所以氢气有1g,水质量为18g,[化学科目]
你看到的是参考书的分析说:氢元素的质量为 2 2
----------- = --------,现在有19克混合液,则其中含
(依照其中的质量比计算对应成分的质量分数) 17+2 19
氢元素为2g.这里看懂了吧?标记1
然后看这个混合溶液体系,加MnO2是催化剂来的,不参与反应,里面的水从头到尾也不反应,再看过氧化氢:
2H2O2=MnO2=2H2O+02↑
最后生成了水,整个体系反应前后,氢元素守恒,跑掉的只是氧气.这里看懂了吧?标记2
那么整个体系在反应后全部是水,根据氢元素守恒,含有2g氢元素的水是18g,反应前19-反应后18=1g.
至于过氧化氢的质量在哪,含有多少,并不重要,因为反应后它也变成了水,跟另外一个“杂质”成为了一样的东西.反应前是2种东西,反应后是同一种东西,就可以用氢元素守恒来计算反应后的水.
这个就是参考书说的水为18g的由来,这个思路很精妙,分析十分垃圾,省略太多,跳跃性太大.如果不是我这样的大神级人物来给你讲解,估计你是搞不懂的.哇哈哈!
若有还有问题,欢迎追问
题3: 过氧化氢溶液,氢元素与氧元素质量比为2:17,19克这样的过氧化氢溶液,放入1克二氧化锰,充分反应后,会产生多少克氧气?[化学科目]
1g
解析:
方法一:设过氧化氢溶液中过氧化氢的质量为x,水的质量为y
则:x+y=19;
(x/17+y/9)/(16x/17+8y/9)=2/17
求解可得过氧化氢的质量,再求O2(类似楼上)
方法二:元素守恒法(快速)
双氧水溶液中氢元素质量为19g*2/(2+17)=2g
双氧水完全反应后生成水和氧气,氢元素的质量没有改变
所以反应后水的质量为 2g/(2/18)=18g
则生成氧气的质量为 19g-18g=1g
希望能帮到你
题4: 过氧化氢中氢氧两元素的比2:17,19g过氧化氢和1g二氧化锰反应,生成的氧气是多少g?A1gB1.6gC4.2gD8.5g[化学科目]
这道题目,应该是过氧化氢不纯吧
2H2O2==MnO2==2H2O+O2
你看这个生成的氧气,氧元素占过氧化氢的一半
所以是19*7/19*1/2=8.5g
题5: 已知双氧水中氢元素与氧元素的质量比为2:17将19克该双氧水与1克二氧化锰中充分反应求反应后生成氧气质量[化学科目]
双氧水溶液中氢元素质量为19g*2/(2+17)=2g
双氧水完全反应后生成水和氧气,氢元素的质量没有改变
所以反应后水的质量为 2g/(2/18)=18g
则生成氧气的质量为 19g-18g=1g
