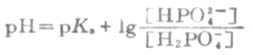【溶液PH怎么算】PH值是如何计算出来的_化学_8001k4554
编辑: admin 2017-15-06
-
4
pH的计算之一
常用H+浓度来表示溶液的酸碱性,当[H+]小于1mol·L-1时,为了使用方便,常用氢离子浓度的负对数,即-lg[H+]来表示溶液的酸度,并称为pH,即pH= -lg[H+].
任何物质的水溶液中[H+]·[OH-]=Kw,室温时Kw=1×10-14.纯水中[H+]=[OH-]=10-7mol·L-1,则pH= -lg[H+]=7.在其他中性溶液中[H+]=[OH-]=10-7mol·L-1,pH也为7;酸性溶液中[H+]>[OH-],其pH<7;碱性溶液中[H+]<[OH-],其pH>7.氢氧离子浓度的负对数也可表示为pOH,则溶液的pH + pOH = 14,pH=14 - pOH.计算溶液的pH关键在于正确求出各种溶液的[H+],具体计算如下:
例1 计算0.01mol·L-1盐酸溶液的pH.
解 盐酸是强电解质,在水中全部电离[H+]=0.01mol·L-1pH=-lg[H+]=-lg 0.01=2
答 该溶液的pH为2.
例2 计算c=0.1mol·L-1醋酸溶液(电离度α=1.34%)的pH.
解 醋酸是弱电解质在水中部分电离
[H+]=α·C=1.34%×0.1
=1.34×10-3(mol·L-1)
pH= -lg[H+]=-lg 1.34×10-3=2.87
答 该溶液的pH为2.87.
例3 计算c(NaOH)=0.1mol·L-1氢氧化钠溶液的pH.
解 NaOH为强电解质在水中全部电离
[OH-]=0.1mol·L-1
pH= -lg[H+]=-lg10-13=13
另一算法:
pH=14-pOH=14-(-lg[OH-])=14-1=13
答 该氢氧化钠溶液的pH为13.
例4 某溶液的pH=5求该溶液的H+和OH-的浓度.
解 pH=5=-lg[H+] [H+]=10-5(mol·L-1)
答 该溶液的H+浓度为10-5mol·L-1,OH-的浓度为10-9mol·L-1
pH的计算之二
1.简单酸碱溶液的pH
由pH= -lg[H+],只要求得[H+]即可.
(1)一元强酸:[H+]=C酸 二元强酸:[H+]=2C酸
弱酸:[H+]=Cα,再求pH.
(2)一元强碱[OH-]=C碱,二元强碱:[OH-]=2C碱,
2.强酸,强碱的稀释
(1)强酸稀释过程pH增大,可先求稀释后溶液的[H+],再求pH.
(2)强碱稀释后pH减小,应先求稀释后,溶液中的[OH-],再求[H+],才能求得pH.
(3)极稀溶液应考虑水的电离.
酸溶液pH不可能大于7,碱溶液pH不可能小于7.
3.强酸、强碱溶液的混合
等体积混合时:
若pH相差2个单位以上“pH混=pH小+0.3”
若pH相差1个单位“pH混=pH小+0.26”
(2)两强碱混合:
等体积混合时:
若pH相差2个单位以上“pH混=pH大-0.3”
若pH相差1个单位“pH混=pH大-0.26”
(3)强酸、强碱溶液混合:
若恰好中和,溶液pH=7.
再求[H+]混,再求pH.
其他同学给出的参考思路:
氢离子浓度以十为底的对数的相反数,平常是1到14,不过没最大值和最小值,负的也行.比如10的-2次方mol/l,PH就是2
互助这道作业题的同学还参与了下面的作业题
题1: PH值的计算方法[化学科目]
ph就是溶液中氢离子浓度的负对数-lg c(H+). 一元强酸溶液可以直接计算酸的浓度 碱的话就要利用Kw 离子积常数.就是氢离子乘氢氧根的浓度积为10负14次方.把碱的oh根浓度带入 计算氢离子浓度 再计算负对数. 水存在电离平衡所以氢氧根和氢离子同时存在在酸碱和中性溶液中那种离子多溶液就显相应的性质,无论酸碱ph只用氢离子浓度来计算
题2: 什么叫ph值?是怎么计算的?[化学科目]
pH值,亦称氢离子浓度指数、酸碱值,是溶液中氢离子活度的一种标度,也就是通常意义上溶液酸碱程度的衡量标准.这个概念是1909年由丹麦生物化学家Søren Peter Lauritz Sørensen提出.p代表德语Potenz,意思是力量或浓度,H代表氢离子(H+).有时候pH也被写为拉丁文形式的pondus hydrogenii.
通常情况下(25℃、298K左右),当pH7的时候,溶液呈碱性,当pH=7的时候,溶液为中性.
pH值允许小于0,如 盐酸(10 mol/L)的pH为-1.
测量
有很多方法来测量溶液的pH值:
在待测溶液中加入pH指示剂,不同的指示剂根据不同的pH值会变化颜色,根据指示剂的研究就可以确定pH值的范围.滴定时,可以作精确的pH标准.
使用pH试纸,pH试纸有广泛试纸和精密试纸,用玻棒蘸一点待测溶液到试纸上,然后根据试纸的颜色变化并对照比色卡也可以得到溶液的pH值.上方的表格就相当于一张比色卡.
pH试纸不能够显示出油份的pH值,由于pH试纸以氢铁制成和以氢铁来量度待测溶液的pH值,但油中没含有氢铁,因此pH试纸不能够显示出油份的pH值.
使用pH计,pH计是一种测量溶液pH值的仪器,它通过pH选择电极(如玻璃电极)来测量出溶液的pH值.pH计可以精确到小数点后两位.
应用
由pH值的定义可知,pH值是衡量溶液酸碱性的尺度,在很多方面需要控制溶液的酸碱,这些地方都需要知道溶液的pH值:
医学上:人体血液的pH值通常在7.35-7.45之间,如果发生波动,就是病理现象.唾液的pH值也被用于判断病情.
化学和化工上:很多化学反应需要在特定的pH值下进行,否则得不到所期望的产物.
农业上:很多植物有喜酸性土壤或碱性土壤的习性,如茶的种植.控制土壤的pH值可以使种植的植物生长的更好.
题3: ph值如何计算[化学科目]
先要测定溶液中的氢离子的浓度mol/L(摩尔/升),取它的以10为底的对数(常用对数),再取负值就是了.一句话:氢离子浓度的负对数.pH=-lg[H+].小于7是酸性,大于7是碱性,等于7是中性.
比如,氢离子的浓度0.0001mol/L,以10为底的对数为-4,pH值就是4,酸性.
题4: PH值是如何计算出来的?[数学科目]
就是先算出溶液中氢离子浓度,然后求负对数:pH=—lgc(H+)
题5: pH值的计算分别称取10g十二水合Na2HPO4与6gKH2PO4,混合后,用蒸馏水定容至100mL,求该溶液的pH?要求写出计算过程[数学科目]
按照缓冲溶液缓冲对pH计算的亨德森方程式pH=pKa+log[HPO4-]/[H2PO42-],用以计算各种组成类型缓冲溶液的PH近似值.当用于弱酸及其对应的盐组成的缓冲溶液的PH值时,PKa即弱酸的离解常数负对数,共轭碱]即[弱酸盐].当用于多元弱酸的酸式盐及其对应的次级盐组成缓冲溶液的PH值时,共轭酸即酸式盐,pKa即该酸式盐负离子的离解常数的负对数,共轭碱即该酸式盐的次级盐.
因为本题中HPO4-浓度为10/358/0.1=0.28mol/L,H2PO42-浓度为6/136/0.1=0.44mol/L,这里的pKa即H3PO4的pKa2=7.21,
所以pH=7.21+log(0.28/0.44)=7.21-0.20=7.01